颠覆认知:研究揭示阿尔茨海默病背后唯一的“罪魁祸首”
亚利桑那州立大学研究团队提出,压力应激颗粒可能是阿尔茨海默病的主要原因,为理解和治疗该复杂疾病提供了新的视角。
阿尔茨海默病,这个困扰无数家庭的复杂疾病,或许迎来了一线曙光。一种全新的疾病模型被提出,它不仅有望加速我们对这种疾病的理解和治愈进程,更可能将该病的所有表现都纳入一个统一的理论框架之下。
来自亚利桑那州立大学的研究人员大胆假设:压力应激颗粒——那些在遗传和环境风险因素作用下,因细胞承受压力而形成的蛋白质和RNA团块,才是导致阿尔茨海默病发生的“幕后真凶”。
为了验证这一猜想,研究团队深入分析了多个健康数据库和过往研究论文的数据,特别是2022年一项关于阿尔茨海默病发展进程的重磅研究。他们试图从中找出疾病发生时基因表达层面普遍存在的改变。
我们已知,阿尔茨海默病早期就会引发基因表达的“大换血”,就像悄无声息地重塑生物通路,从而加剧细胞压力,阻碍神经元之间的沟通,并导致蛋白质异常,比如臭名昭著的淀粉样蛋白团块。
然而,这场基因行为“灾难性转变”的深层原因究竟是什么?它是否真的能解释阿尔茨海默病的一切?这些问题一直困扰着科学家们。
科学家们认为,压力应激颗粒本应在细胞稳态恢复期间发挥保护作用。但在阿尔茨海默病患者体内,情况却截然不同,种种迹象表明,压力应激颗粒持续存在并干扰其他细胞活动,其中最关键的,就是核质运输。核质运输是细胞核与其周围细胞质之间进行重要分子物质交换的通道,一旦受阻,后果不堪设想。
神经科学家 Paul Coleman 指出:“我们的研究提出,细胞核与细胞质之间沟通的瓦解,最终导致基因表达的混乱,这为我们全面理解这种复杂疾病的机制提供了一个合理的框架。” 他补充道,“研究阿尔茨海默病的早期表现,将为诊断、治疗和预防开辟创新途径,从根源上解决问题。”
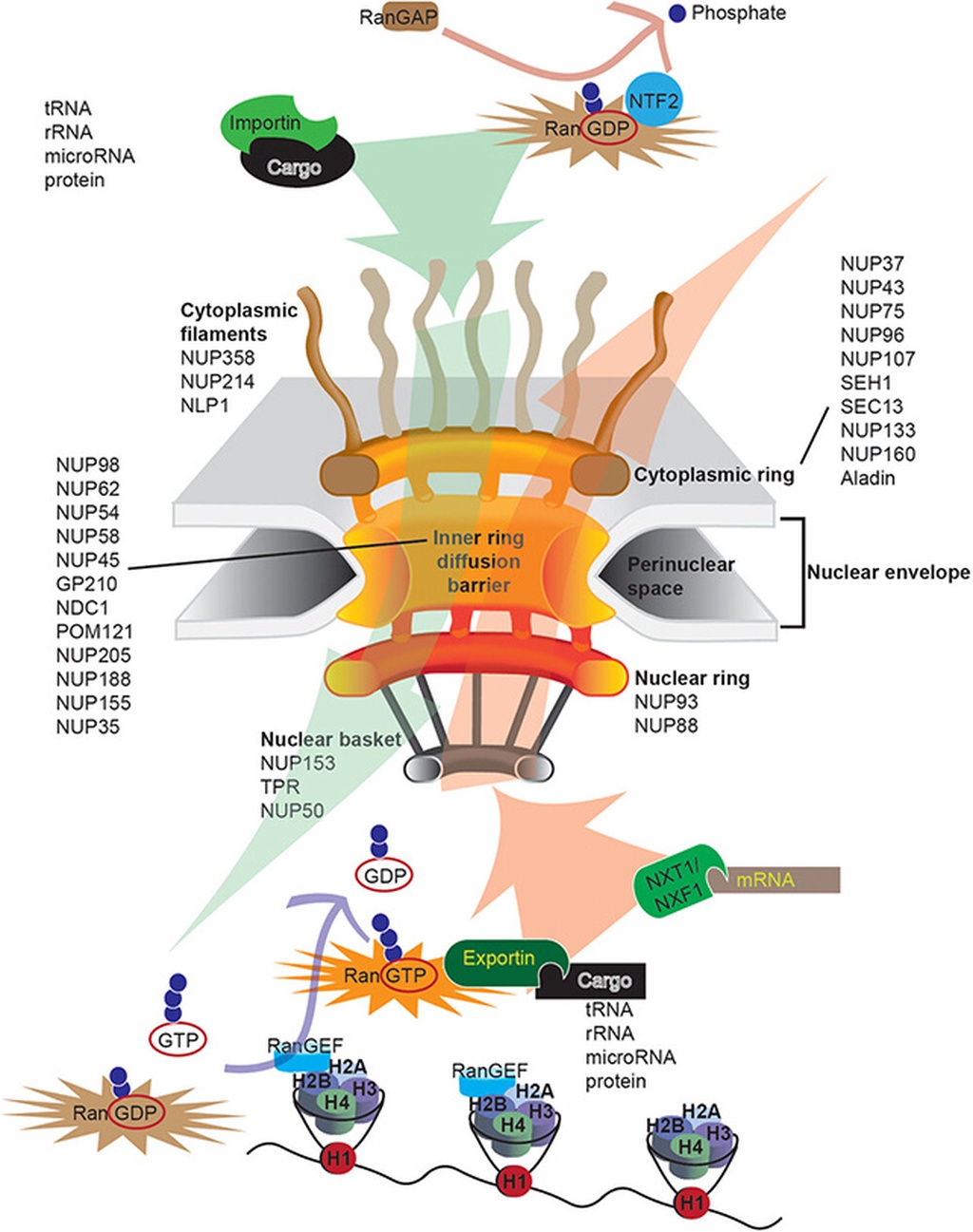
细胞内分子运输的图示
这项假说大胆设想:压力应激颗粒扰乱了细胞的运输系统,进而改变基因表达,而基因表达的改变反过来又引发了阿尔茨海默病的所有症状,包括神经炎症和 tau 蛋白缠结。
换句话说,阿尔茨海默病的所有不同方面,或许都源于同一个“罪魁祸首”。 虽然目前还没有确凿的证据来证实这一观点,但研究人员已经论证了,它与现有的证据高度吻合。
更令人兴奋的是,这种细胞应激现象发生在任何阿尔茨海默病症状出现之前。这无疑为科学家们提供了一个在疾病早期阶段进行阻断的宝贵机会。或许,我们有可能从源头上预防大多数症状的发生。
从空气污染到基因突变,多种因素都可能导致这些压力应激颗粒 “恋恋不舍”,长时间滞留不去。未来的研究将更深入地探究它们的形成机制以及如何造成损害。
Coleman 总结道:“我们的论文有助于推动关于阿尔茨海默病真正开始时间的持续性讨论,这是一个随着技术和研究进步而不断演进的概念。” 他强调,“关键问题在于,何时才能最早检测到疾病?干预应该从何时开始?这两个问题都对社会和未来的医疗策略有着深远的影响。”
本文译自 ScienceAlert,由 BALI 编辑发布。

